Представленный случай демонстрирует сложность диагностики и лечения редкого варианта нетипичного формирования пола (НФП) в виде парциальной дисгенезии гонад (ПДГ). У пациента с нетипичным формированием пола на основании кариотипа 46,ХУ и с патологически высоким соотношением общего тестостерона к дегидротестостерону после стимуляции хорионическим гонадотропином была диагностирована 5-α-2-редуктазная недостаточность. Проведена хирургическая коррекция наружных гениталий в соответствии с мужским полом. Спрогнозирована возможность фертильности и низкого риска онкозаболеваний. Отставание пациента в росте заставило специалистов пересмотреть диагноз через 8 лет после его установки. Были выяв- лены мозаичный кариотип (45,Х/46,ХУ), низкие цифры общего тестостерона, наличие рудиментарной матки, дисгенетичное строение гонад и половых протоков. Диагностирована ПДГ. Удалена рудиментарная матка. Изменен прогноз в отношении фертильности, риска гонадобластомы и опухоли Вильмса.
Источник: А.Б. Окулов, Е.А. Володько, А.В. Аникиев, Ю.Ю. Соколов, К.К. Мираков. Мозаицизм у больного с парциальной дисгенезией гонад и проксимальной гипоспадией. Педиатрия. 2016; 95 (6): 209–212
Парциальная дисгенезия гонад (ПДГ) — редкий вариант нетипичного формирования пола (НФП), характеризующийся различной степенью дисгенезии обоих яичек, нестандартным строением наружных половых органов (НПО) и возможным наличием дериватов Мюллеровых структур [1, 2]. Впервые описан Федерманом как мужской дисгенетический псевдогермафродитизм в 1967 г. [3]. Степень дисгенезии яичек у людей с ПДГ нередко варьирует. Морфологически дисгенетичное яичко может иметь возрастные раз- меры. Придаток, как правило, уменьшен в размере с признаками патологической фиксации. Часто дисгенетичное яичко может иметь вид стрек-гонады [4]. Тестикулярную дисгенезию подтверждают гистопатологические находки в виде гипоплазии, дистрофии извитых канальцев с наличием мелких внутриканальцевых кальцинатов, рыхлой интерстициальной ткани с участками склероза, уменьшения количества герминативных клеток и клеток Сертоли [1, 5, 6]. Неправильное строение гениталий проявляется в виде проксимальной формы гипоспадии с искривлением кавернозных тел, расщепленной мошонки. В ряде случаев гонады пальпаторно определяются в деформированной мошонке или паховой области. В литературе описан единичный случай правильно развитых муж- ских половых органов в сочетании с крипторхизмом у пациента с ПДГ [1]. Наличие пальпируемых гонад у пациентов с неправильным строением НПО обращает на себя внимание с рождения, поэтому такие пациенты попадают в поле зрения врачей уже на первом году жизни. В остальных случаях подозрение на ПДГ появляется у пациентов, воспитывающихся в женском поле, при первичной аменорее или случайном выявлении дисгенетичных яичек во время операции по поводу паховой грыжи, острого аппен- дицита или другой патологии. Однако описаны слу- чаи и антенатальной диагностики ПДГ [7]. Согласно литературным данным, гормональное исследование выявляет сниженный или нормальный уровень обще- го тестостерона (ОТ), нормальный либо увеличенный уровень лютеинизирующего (ЛГ) и фолликулостиму- лирующего (ФСГ) гормонов сыворотки крови [1, 6]. Результат диагностической пробы с хорионическим гонадотропином (ХГЧ), позволяющий определить наличие функционирующих клеток Лейдига в ткани яичка, по данным ряда авторов, может варьировать от положительного до слабоположительного в зави- симости от степени дисгенезии гонад [6]. Низкий уровень Мюллер-ингибирующей субстанции у паци- ентов с ПДГ, характеризующий функциональную недостаточность клеток Сертоли, определяет наличие дериватов Мюллеровых протоков. Рудиментарную матку, маточные трубы, влагалище, дренирующее- ся через урогенитальный синус в простатическую уретру различной степени выраженности, определя- ют с помощью эхографического и эндоскопического исследований, а также путем комбинации данных методов. Наиболее информативным методом визуа- лизации гонад является лапароскопия. В работах отечественных исследователей дисгенетичные яички в брюшной полости локализовались в толще широкой связки матки либо в проекции пахового кольца [8]. Авторы считают обязательным для людей с ПДГ
цитогенетическое исследование: кариотипирование и FISH-анализ интерфазных клеточных ядер, генных мутаций и сопутствующих аномалий. Как правило, пациенты с ПДГ имеют мужской кариотип 46,ХУ. В редких случаях они являются носителями мозаич- ного кариотипа. В доступных литературных источ- никах представлены единичные клинические описа- ния ПДГ с кариотипом 45,Х/46,ХУ, 45,Х/46,ХУУ и 45,X/46,X+mar [9, 10]. Известно, что риск развития гонадобластомы и опухоли Вильмса у больных с мозаи- цизмом значительно увеличивается до 20% [11] и 46% [12] соответственно. Дизгенезия гонад в сочета- нии с нефропатией и опухолью Вильмса описана как синдром Денис–Драш и проявляет себя ранним появ- лением протеинурии, артериальной гипертензии, сни- жением функции почек и высокой смертностью [13].
Отправной точкой в реабилитации больных с ПДГ считают присвоение пола воспитания. По мнению большинства авторов, решение о выборе пола должно приниматься на основании локализации и функцио- нальной возможности гонад, внешнего вида НПО и возможности их коррекции в соответствии с выбран- ным полом. Этот сложный процесс должен проходить с участием как родителей, так и специалистов различ- ного профиля — эндокринологов, хирургов, генети- ков, морфологов, гинекологов, психологов, психиат- ров, сексологов. Многие авторы рекомендуют выбор мужского пола воспитания у пациентов с ПДГ в слу- чае функциональной состоятельности хотя бы одной гонады (яичко) в виде положительного клинического и гормонального ответа на стимуляцию ХГЧ [2, 5, 14].
Коррекцию ПДГ проводят в соответствии с выбранным полом. У всех пациентов удаляют дери- ваты Мюллеровых структур и стрек-гонады, кор- регируют сопутствующюю патологию. При выборе мужского пола низводят яички в мошонку и выпол- няют маскулинизирующую пластику НПО. При выбо- ре женского пола вместе с дериватами Мюллеровых структур (рудиментарная матка и измененные маточ- ные трубы) удаляют дисгенетичные гонады, выпол- няют феминизирующую пластику НПО, назначают заместительную гормональную терапию в пубертате. Пациентам с мозаичным кариотипом и микроделеци- ями Y-хромосомы в связи с риском опухоли Вильмса и гонадобластомы выполняют онкологический скри- нинг либо профилактически удаляют гонады [13]. Редкость заболевания, сложность его диагностики и лечения обусловливают необходимость концентрации внимания от команды врачей специалистов [6, 14, 15]. В представленном клиническом случае ПДГ некор- ректное определение кариотипа в периоде раннего детства привело к ошибочному диагнозу, уточнение которого с изменением прогноза произошло только через 8 лет после первичного обследования.
Больной Б., 2001 года рождения, впервые обследован эндокринологом в возрасте 2 лет 4 месяцев по поводу неправильного строения НПО в виде промежностной гипоспадии, расщепленной мошонки, искрив- ления кавернозных тел, правостороннего крипторхиз- ма. К моменту обследования ребенок был зарегистри- рован и воспитывался в мужском поле. Методом G окрашивания хромосом определен кариотип 46,ХУ. Кавернозные тела искривлены, длиной 3 см, головка хорошо сформирована. Наружное мочеполовое отверстие открывается на промежности. Мошонка расще- плена. Гонады пальпируются слева в проекции дна мошонки, справа в проекции корня мошонки. По данным гормонального исследования: гормоны над- почечников – в пределах нормы; ОТ 0,069–0,1 нг/мл (норма 0,1–0,35 нг/мл); дигидротестостерон (ДГТ) 16,3 пг/мл (норма 5–50 пг/мл); ЛГ менее 0,1 МЕ/л (норма 1,1–7 МЕ/л); ФСГ 0,632 МЕ/л (норма 1,7–12 МЕ/л); через 72 ч после введения 3000 Ед. прегнила ОТ 5,51 нг/мл; ДГТ 48,2 пг/мл; соотношение ОТ/ ДГТ 32,4 (норма до 20). Эхографически левая гонада локализуется в мошонке объемом 0,26 см3, правая определяется в паховом канале на границе средней и нижней трети, объемом 0,39 см3. В проекции мало- го таза определяется мешкообразное жидкостное образование, увеличивающееся после опорожнения мочевого пузыря. Почки расположены типично, раз- меры их соответствуют возрастной норме, толщина паренхимы и кортико-медуллярная дифференциров- ка сохранены, чашечно-лоханочная система (ЧЛС) не расширена. По данным кардиологического обследо- вания выявлен врожденный порок сердца — субаор- тальная мембрана. Получен положительный эффект пробы с сустаноном в виде увеличения кавернозных тел, учащения эрекций, что позволило говорить о сохранной чувствительности рецепторов к андрогенам и определяло успешную адаптацию в мужском поле. Вариант НФП расценен как дефицит 5-α-2-редуктазы. Выполнена этапная маскулинизирующая пластика НПО: в возрасте 3 лет 6 месяцев расправление кавер- нозных тел; в 4 года 6 месяцев низведение и фикса- ция правого яичка, меатотомия; в 5 лет 6 месяцев пластика промежностной части уретры по Дюплею с использованием прецизионного шва; в 6 лет 9 месяцев заготовка кожного лоскута из крайней плоти; в 7 лет 9 месяцев пластика висячей части уретры по Дюплею с использованием презиционного шва.
При обследовании в возрасте 10 лет обращено вни- мание на низкие темпы роста, задержку физического развития, отставание костного возраста. При проведе- нии стимуляционных проб с соматотропным гормоном – дефицита не выявлено. Молекулярно-генетическое исследование методом полимеразных цепных реакций и последующего секвенирования последовательности экзонов 1–5 и примыкающих участков интронов гена SRD5A2, а также исследование гена AR мутаций не выявило. Проведено повторное гормональное иссле- дование: антимюллеров гормон 30,22 нг/мл (норма 3,8–159,8 нг/мл), ОТ 14,38 нмоль/л, ДГТ 3,2 нмоль/л, соотношение Т/ДГТ 4,51 (норма до 20). При определе- нии кариотипа методом FISH-анализа интерфазных клеточных ядер в препаратах культуры лимфоци- тов периферической крови выявлен клон 45Х в 65% клеток. Повторное обследование больного по при- чине отставания в росте позволило исключить ранее поставленный диагноз дефицита 5-α-2-редуктазы и выявить мозаицизм.
В возрасте 14 лет перенес острый правосторонний орхоэпидидимит, в связи с чем повторно обследован. Вес 43 кг, рост 147 см (SDS роста – 1,94 δ), индекс массы тела 19,9 кг/м2 (+0,43 SD). Правильного тело- сложения. НПО сформированы по мужскому типу.
Половое развитие: по Таннер P3, G 2–3. Яички эла- стичной консистенции пальпируются в мошонке, справа 4,5 мл, слева – 6 мл. Правая половина мошон- ки увеличена, пальпация правого яичка болезненная в проекции придатка, кожа не изменена. Кавернозные тела развиты удовлетворительно, не искривлены, дли- ной 4 см. Наружное отверстие неоуретры открывается под венечной бороздой, широкое, мочеиспускание не затруднено. При обследовании гормоны щитовидной железы в пределах нормы; ОТ 3,32 нг/мл (норма 3–10,6 нг/мл); ДГТ 16,3 пг/мл (норма 5–50 пг/мл); ЛГ 3,18 МЕ/л (норма 1,1–7 МЕ/л); ФСГ 3,94 МЕ/л (норма 1,7–12 МЕ/л), β-ХГЧ 1,5 мкЕД/мл (норма 0–2,67 мкМЕ/мл), α-фетопротеин 2,53 нг/мл (норма 0–9 нг/мл). В анализе мочи по Нечипоренко лейко- цитурия 3000 в поле зрения, которая расценена как признак инфекции мочевых путей. Эхографически выявлены диффузные, очаговые изменения придат- ка правого яичка, предположительно воспалитель- ного характера, диффузные изменения левого яичка. Признаки влагалищного отростка урогенитального синуса небольших размеров с маточным утолщением на верхушке. В связи с подозрением на наличие в малом тазу рудиментарной матки и клиникой остро- го правостороннего орхоэпидидимита установлены показания к повторному комплексному исследова- нию половых протоков, диагностически санацион- ной лапароскопии и ревизии правого яичка, которые выполнены 18.03.16. При эндоскопии половых прото- ков выявлен влагалищный отросток урогенитального синуса (ВОУГС) размерами 6х2 см, дренирующийся через щелевидное отверстие на верхушке гипоплази- рованного семенного бугорка в уретру. При лапаро- скопии: глубокие паховые кольца с обеих сторон обли- терированы, в них входят гонадальные сосудистые пучки. В малом тазу выявлена рудиментарная матка без маточных труб, размерами 1х1,5 см, переходящая в ВОУГС. Семявыносящие протоки толщиной справа 3 мм, слева – 2 мм, начинаются с двух сторон от проксимальной трети ВОУГС, прослеживаются на протяжении 3 см, затем истончаются и не опреде- ляются в области глубоких паховых колец. Матка мобилизована и удалена над местом впадения семявы- носящих протоков в ВОУГС путем наложения петли Рёдера (рис. 1).
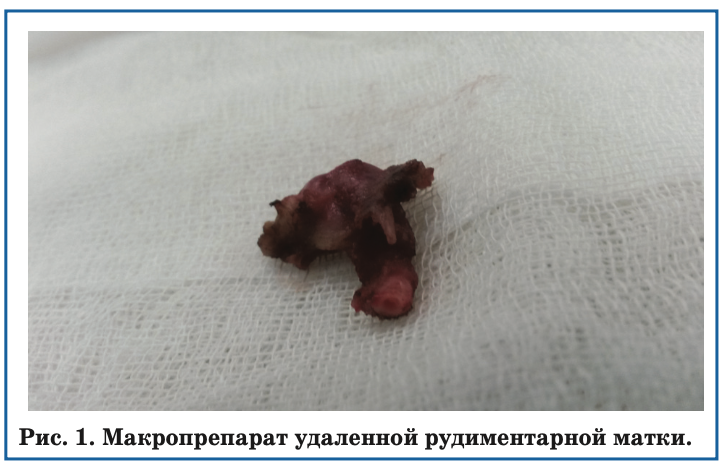
Гистологически обнаружены признаки эмбриональной матки. Выполнена ревизия правой гонады. Последняя овальной формы, белесо-желтого цвета, эластичной консистенции, 2,5х2х1 см (рис. 2).
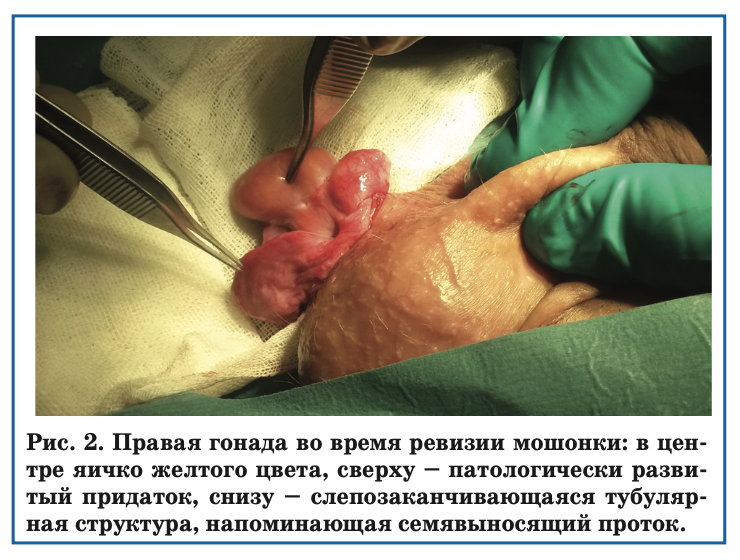
Взята биопсия. Гистологически определяется ткань яичка со сформированными семенными канальцами, вариабельными по размеру, без просветов, без призна- ков функциональной активности, с незрелыми клет- ками Сертоли, между которыми отмечаются гермина- тивные клетки, между канальцами поля и скопления клеток Лейдига. Семявыносящий проток не визуали- зируется. Проксимальнее гонады выявлена структура желтого цвета, напоминающая придаток яичка. Взята биопсия. Гистологически дисгенетичный придаток яичка. Дистальнее гонады выявлена извитая тубуляр- ная структура темно-бордового цвета, плотной конси- стенции. Взята биопсия. Гистологически элементы гипоплазированного семенного канатика с семявыносящим протоком.
По результатам предварительного обследова- ния, комплексного исследования половых прото- ков, диагностически санационной лапароскопии ребенку поставлен диагноз НФП 45,Х/46,ХУ ПДГ. Послеоперационный период на 2-е сутки осложнился признаками инфицирования гематомы правого яичка с гипертермией. После смены антибактериальной терапии лихорадка купирована.
Ребенок выписан в удовлетворительном состоянии на 11-е сутки после операции. Рекомендовано наблюдение уролога, эндокринолога, кардиолога по месту жительства; анализ крови на α-фетопротеин, β-ХГЧ, лактатдегидрогеназу один раз в 6 месяцев; определение титров антител М и G к цитомегалови- русу (ЦМВ), токсоплазме, микоплазме человеческой, хламидии трахоматикус с целью микробиологическо- го мониторинга; в случае превышения референтных показателей онкомаркеров – консультация онколога.
Неправильное строение НПО, половых про- токов и половых желез является признаком НФП. Определение варианта НФП является важной зада- чей, от которой зависят своевременный и адекват- ный выбор пола пациента, хирургическая тактика, мониторинг прогноза репродуктивного здоровья и схема мультидисциплинарных реабилитационных мероприятий с учетом онкологической насторожен- ности. НФП по типу ПДГ с мозаичным кариотипом обусловливает не только определение пола, хирурги- ческую коррекцию наружных гениталий в выбранном поле, возможную гормональную и психологическую поддержку в периоде пубертата, но в отличии от 5-α-2- редуктазной недостаточности обязательный скрининг и профилактику гонадобластомы и опухоли Вильмса. Такие больные инфертильны. Иными словами, непра- вильное строение половых органов у пациентов с различными вариантами НФП могут потребовать не только различных подходов к лечению, но иметь раз- личные прогнозы в отношении адаптации в выбран- ном поле и развития онкологических заболеваний.
Таким образом, пациентам с признаками ПДГ необходимо тщательно исследовать кариотип в связи с тем, что он является ключевым в оценке прогноза психосоциального, психосексуального статуса и раз- вития опухолей.
Конфликт интересов: авторы сообщили об отсутствии конфликта интересов.
1. Juliana Gabriel Ribeiro de Andrade, Antonia Paula Marques-de-Faria, Helena Campos Fabbri, Maricilda Palandi deMello, Gil Guerra-Júnior, Andréa Trevas Maciel- Guerra. Long-Term Follow-Up of Patients with 46,XY Partial Gonadal Dysgenesis Reared as Males. International Journal of Endocrinology. 2014; Article ID 480724: 8 p. doi:10.1155/2014/480724: 8
2. Crone J, Amann G, Gheradini R, Kirchlechner V, Fékété CN. Management of 46, XY partial gonadal dysgenesis— revisited. Wien. Klin. Wochenschr. 2002; 114 (12): 462–467.
3. Federman DD. Abnormal sexual development. N. Engl. J. Med. 1967; 277: 51–60.
4. Márcia Ribeiro Scolfaro, Izilda Aparecida Cardinalli, Eliana Gabas Stuchi-Perez, Maricilda Palandi de Mello, Juliana de Godoy Assumpção, Maria Tereza Matias Baptista, et al. Morphometry and Histology of Gonads From 13 Children With Dysgenetic Male Pseudohermaphroditism. Archives of Pathology & Laboratory Medicine. 2001; 125 (5): 652–656.
5. Verkauskas G, Malcius D, Eidukaite A, Vilimas J, Dasevicius D, Bilius V, Hadziselimovic F. Prospective study of histological and endocrine parameters of gonadal function in boys with cryptorchidism. J. Pediatr. Urol. 2016; 12 (4): 238. e1–6. doi: 10.1016/j.jpurol.2016.05.007. Epub 2016 May 27.
6. Райгородская Н.Ю., Морозов Д.А., Болотова Н.В., Цмокалюк Е.Н., Жарков Д.А., Айрян Э.К. Врожденные нару- шения дифференцировки гонад: клинико-морфологические варианты и оперативное лечение. Урология. 2012; 5: 86–91.
7. Mazza V, Ottolenghi C, Di Monte I, Baldassari F, Rivasi F, Volpe A, Forabosco A. Early prenatal diagnosis of recurrent 46,XY partial gonadal dysgenesis. Prenat. Diagn. 2003; 23 (9): 716–721.
8. Мираков К.К., Володько Е.А., Окулов А.Б., Годлевский Д.Н., Аникиев А.В., Поварнин О.Я. Лапароскопия в диагно- стике и лечении нарушений формирования пола у детей. MEDICUS. Международный медицинский научный журнал. 2016; 2 (8): 122–124.
9. Ságodi L, Jakab J, Kiss A, Ladányi E, Balogh E, Ujfalusi A, et al. Dysgenetic male pseudohermaphroditism. Orv. Hetil. 2012; 153 (8): 303–307.
10. Hashimoto H, Maruyama H, Koshida R, Okuda N, Mu- rayama K, Katsumi T, et al. Presence of Turner stigmata in a case of dysgenetic male pseudohermaphroditism with 45,X/46,X+mar karyotype. Arch. Dis. Child. 1997; 76 (3): 268–271.
11. Verp MS, Simpson JL. Abnormal sexual differentiation and neoplasia. Cancer Genet. Cytogenet. 1987; 25 (2): 191–218. 12 Manuel M, Katayama PK, Jones HW. The age of occur- rence of gonadal tumors in intersex patients with a Y chromosome. Jr. Am. J. Obstet. Gynecol. 1976; 124 (3): 293–300.
13. David Andrew Diamond, Richard N. Sexual Differentiation: Normal and Abnormal. In: Campbell-Walsh
Urology. 10th Ed. Philadelphia: W.B. Saunders, 2012: 3611. 14. Болотова Н.В., Морозов Д.А., Райгородская Н.Ю. Критерии клинической диагностики и выбор лечебной так- тики у пациентов с неопределенностью пола. Саратовский научно-медицинский журнал. 2010; 6 (1): 178–182.
15. Окулов А.Б., Бровин Д.Н., Курило Л.Ф., Черных В.Б., Мираков К.К., Окулов Е.А., Ахмина Н.И. Диагностика нару- шений формирования пола у детей: Учебное пособие для интернов, ординаторов, врачей. М.: РМАПО, 2005




